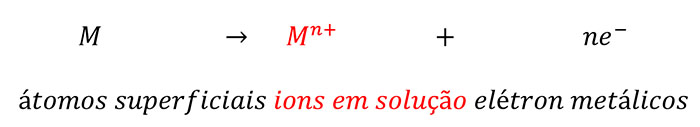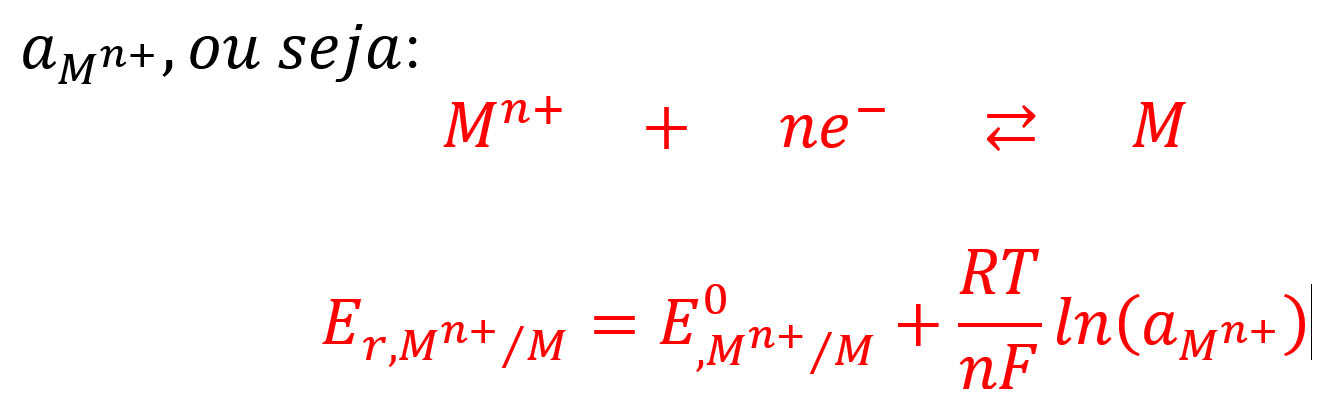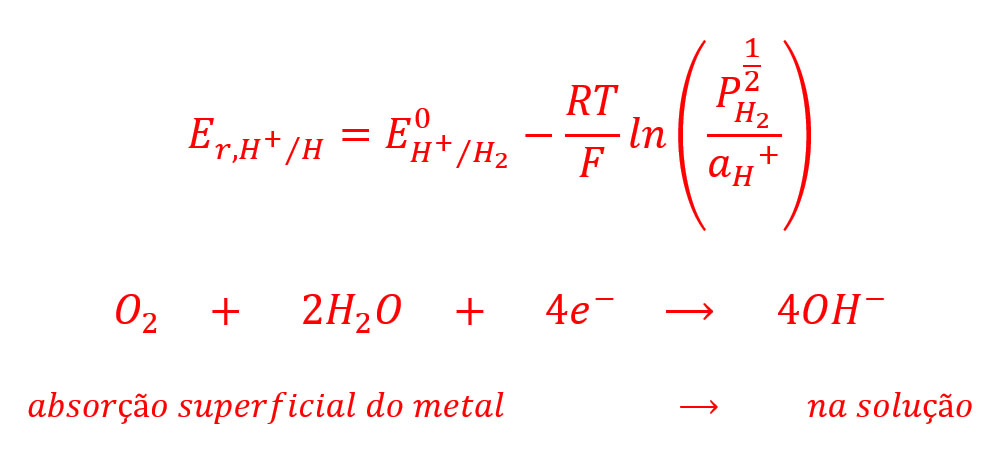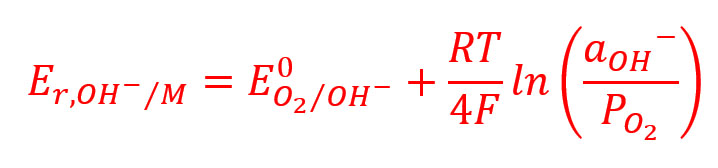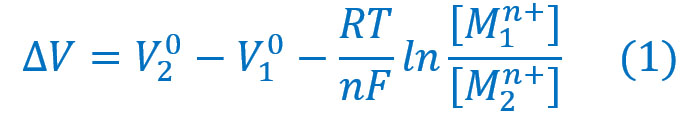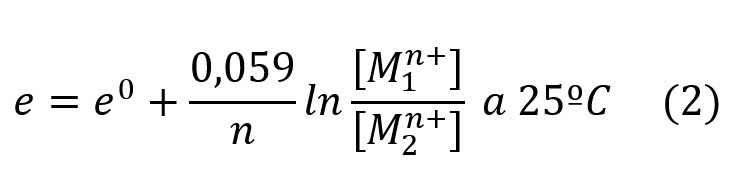por Geraldo. R. de Almeida (MSc - DSc)
Resumo
A corrosão de materiais por fatores ambientais é bastante conhecida por todos que militam na área. Os materiais elétricos de composição metálica também sofrem de maneira intensa os efeitos da corrosão especialmente quando estão em contato com a terra. Os materiais metálicos de uso elétrico possuem duas regiões especialmente vulneráveis ao ataque químico de corrosão: O Eletrodo de Tensão e o Eletrodo de Terra. A escolha dos materiais elétricos de desempenho mecânico resistentes a corrosão parece estar consolidada indicando como a zincagem do aço a tecnologia mais econômica para a proteção contra a corrosão seja ela de qualquer tipo. Entretanto, quando os mesmos materiais zincados são percorridos por corrente ou ficam em contato com a terra, o efetivo desempenho continua aberto. Neste trabalho, além de investigar a fragilidade do zinco, retomaremos uma antiga abordagem de potencial eletroquímico em meio aquoso numa matriz de solo. A matriz de solo (diversos tipos de terra) úmida será tratada com diversos (Ph) – que de um ponto de vista elétrico, corresponderá às diversas resistividades elétricas. Este trabalho é o primeiro de uma série que busca resolver o problema de confiabilidade destes materiais.
INTRODUÇÃO
Os materiais usados em sistemas de aterramento, especialmente no sistema elétrico de potência, são: cobre, alumínio, zinco e aço (ou combinações destes como o aço revestido). Entre os quatro materiais, todos têm propriedade de condução elétrica decrescendo na ordem apresentada, mas como o aterramento é solicitado apenas durante curto circuitos e surtos de frente rápida, muitos engenheiros eletricistas de aterramento têm feito a opção de projetar aterramento com o material mais barato.
A decisão seria perfeita se todos materiais tivessem o mesmo comportamento à corrosão quando em contato com a terra. A Terra é o maior depósito de íons do planeta, por isso todo material em contato com esta deverá procurar um novo estado de equilíbrio termodinâmico. Esse novo estado traz, sem dúvida, uma reação química que promove a transformação de qualquer metal.
Esse artigo aborda a escolha do material de aterramento para contato constante com a terra na sua concepção original, ou seja, na forma mais simples assim como foi obtido na metalurgia física no estágio final da transformação de minério para material de engenharia da modalidade metal.
A teoria usada para essa qualificação do material de aterramento será aquela desenvolvida por Marcel Pourbaix em 1945.
MODELO DE POURBAIX
Existe uma explicação simples, mas essencial do porquê os metais se corroem. Na natureza, há metais puros encontrados denominados nobres: Ouro Prata, Platina, Paládio, Irídio, Rhodio. Esses metais são encontrados puros sem nenhuma evidência de oxidação, pelo menos na temperatura ambiente. Todos são ótimos condutores elétricos, mas escassos na crosta terrestre, por isso muito caros para aplicação em aterramento elétrico.
Com exceção dos metais nobres, todos os demais se oxidam ou se corroem em ataque químico, de alguma forma. Os quatro metais já citados como possíveis materiais de eletrodo de terra são sensíveis ao ataque químico, especialmente a oxidação.
A simples explicação para essa “vontade” de se corroer é explicada pela entropia que governa todas as coisas. O metal como material de engenharia, para sua utilização, necessita de vários estágios de transformação metalúrgica e purificação para eliminar a escória que vem dos minérios onde são extraídos. Agora, o metal quer voltar ao seu estado inicial de equilíbrio antes de sua “purificação”. Em outras palavras, a Terra está reivindicando sua parte tomada. Tal conceito termodinâmico tão simples explica por que os metais se corroem naturalmente.
O mecanismo natural decorre do potencial eletroquímico (Ep) dos elementos metálicos que aparece após a metalurgia de purificação dos minérios, devido à retirada do oxigênio deles. Após a purificação, os minérios passam a ser materiais metálicos e isso significa a existência de elétrons de condução na superfície destes materiais. Esses elétrons de condução, quando em contato com o solo, tendem à oxidação ou formação de sal metálico conforme o pH do meio.
O mecanismo anterior é natural (espontâneo) mas quando passa alguma corrente o mecanismo passa a ser forçado. A corrente circulante é apenas um reforço do mecanismo anterior, mas apresenta diferenciação conforme a corrente circulante no eletrodo de terra seja de origem contínua ou alternada.
O eletrodo de terra é um dispositivo do sistema elétrico de potência, instalado para prover um caminho fácil de grandes descargas de elétrons, seja de origem de curto, seja de origem de surtos atmosféricos ou de manobra, para a terra. O modelo de Pourbaix é um instrumento apenas para estudo de corrosão natural.
Marcel Pourbaix [1] equacionou e resolveu o problema de equilíbrio termodinâmico de metais em contato com meio aquoso. A terra umedecida é um destes meios. O equacionamento partiu do comportamento da água para diversos valores de pH frente a um eletrodo padrão de hidrogênio (SHE em literatura inglesa).
As superfícies de todos os metais (exceto ouro) no ar são cobertas com películas de óxidos. Quando tal metal é imerso numa solução aquosa, a película de óxido tende a dissolver-se. Se a solução é ácida, a película de óxido pode dissolver completamente deixando uma superfície metálica, o que é dito estar no estado ativo. Em soluções quase neutras, a solubilidade do óxido será muito menor do que em solução de ácido e o grau de dissolução tende a ser menor. O metal pode, em seguida, ficar exposto inicialmente somente em pontos localizados, onde, devido a alguma descontinuidade no metal, por exemplo, a presença de uma inserção ou uma fronteira de grão, o filme de óxido pode ser mais fino ou mais propenso a dissolução do que em outros lugares. Se a solução quase neutra inibindo contém ânions, essa dissolução da película de óxido pode ser suprimida e a película de óxido estabilizada passa formar uma película de óxido de passivação, que pode impedir de forma eficaz a corrosão do metal, o qual está, em seguida, no estado passivo.
Quando a superfície livre de óxido de um metal fica exposta à solução, carregada positivamente íons metálicos tendem partir do metal para a solução, deixando atrás elétrons no metal, isto é:
A acumulação de carga negativa no metal devido aos elétrons residuais conduz a um aumento da diferença de potencial entre o metal e a solução. Esta diferença de potencial é denominada o potencial de eletrodo, ou, simplesmente, o potencial de metal, que, assim, se torna mais negativo. Esta mudança no potencial tende a retardar a dissolução de metais íons mas para encorajar a deposição de íons metálicos dissolvidos da solução sobre o metal, isto é, o inverso da reação (1). A Continuação da dissolução e deposição de íons metálicos resultaria no metal atingir um potencial estável de tal modo que a taxa de dissolução se torna igual à taxa de deposição. Este potencial é denominado o reversível e seu potencial (Er) valor depende da concentração de íons metálicos dissolvidos e o padrão reversível (Eo) potencial para a atividade da unidade de íons metálicos dissolvidos,
Onde pH2 é a pressão parcial (fugacidade) de gás de hidrogênio. Se a pressão parcial de hidrogênio é deixada a acumular-se, em seguida, o potencial da reação reversível (4) pode ser atingido. Mas nenhuma outra reação líquida de ions de hidrogênio e por isso iria ocorrer a dissolução do líquido íons metálicos efetivamente cessar. Normalmente hidrogênio escapa do sistema, de modo que permanece apenas o potencial mais negativo do que o potencial de corrosão e assim, continua reversível.
Em meio neutro, a concentração de íons de hidrogênio é muito baixa para permitir a reação (4) a proceder a um ritmo significativo, mas os elétrons no metal podem reagir com moléculas de oxigênio, adsorvido sobre a superfície do metal a partir de ar dissolvido na solução, para a produção de íons hidroxila adsorvidos sobre a superfície do metal, no metal em solução.
Mais uma vez, o potencial do metal continua a ser mais negativo do que o potencial para reversível reação (6).
Assim, a corrosão pode prosseguir através do acoplamento de reações (1) e (6).
Na terminologia eletroquímica, um eletrodo no qual ocorre uma reação de oxidação é chamado um ânodo. O processo de oxidação envolve uma perda de elétrons por espécies reagentes, conforme ocorre na reação de metal de dissolução (1). Assim, uma área de um metal em que o metal corroendo dissolução ocorre é um ânodo de metal e de dissolução é a reação de corrosão anódica. Um eletrodo no qual ocorre uma reação de redução é chamado de cátodo.
M. Pourbaix [1] equacionou e resolveu o problema de energia de potencial eletroquímico em função do pH do meio através da equação (1) de NENRST [3].
Onde:
A equação (1) anterior, convenientemente modificada por POURBAIX toma forma.
Considerando que por definição.
Para meia célula de .
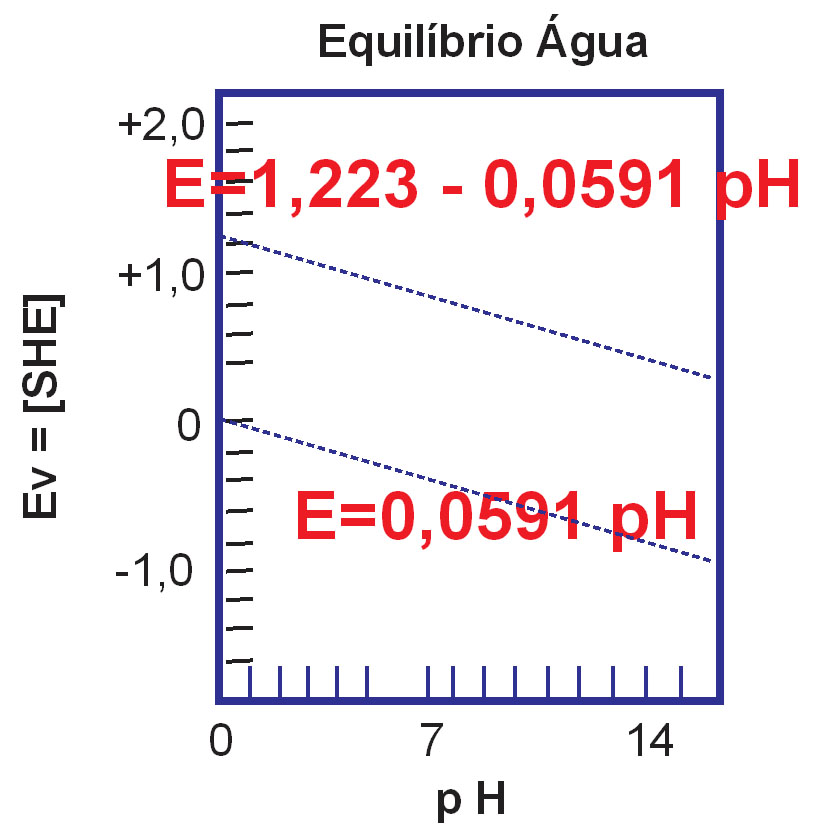
A equação (3) anterior permite construir um simples diagrama de potencial eletroquímico da água em relação ao pH conforme ilustra a figura a seguir.
Figura 01 - Pourbaix na água
A mesma equação de NERNST pode ser tomada para um metal genérico, considerando todos seus estados de valência e todas as possibilidades de reação com o meio (inclusive a água). A seguir, para ficar mais claro a construção do diagrama de fase em corrosão será apresentada a seguir a construção do diagrama do zinco.
DIAGRAMA DE POURBAIX
Os diagramas de Pourbaix fornecem uma visão inicial como o metal vai se comportar num ambiente aquoso no que concerne ao ataque químico de corrosão. Os diagramas de Pourbaix possuem as seguintes características:
- O pH é plotado no eixo horizontal e o potencial redox E vs. SHE no eixo horizontal.
- As linhas horizontais representam reações de transferência de elétrons. Elas são independentes do pH, mas dependem do potencial.
- As linhas verticais são independentes do potencial, mas dependem do pH e não são acompanhadas por qualquer transferência de elétrons
- As linhas retas e inclinadas fornecem os potenciais redox de uma solução em equilíbrio com hidrogênio e oxigênio, respectivamente. Esse equilíbrio indica transferência de elétrons e pH.
- Presume-se que a concentração de todos os íons metálicos seja de 10 a 6 mol por litro de solução. Em concentrações mais baixas, a corrosão não deve ocorrer.
- O diagrama é calculado para as condições de equilíbrio a 25°C.
- A extremidade superior do potencial redox ax-is é a extremidade nobre e a extremidade inferior, a extremidade ativa, significando que o poder oxidante aumenta com o aumento do potencial.
- As linhas de hidrogênio e oxigênio são indicadas nos diagramas de Pourbaix por linhas pontilhadas.
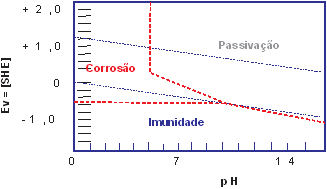
O diagrama didático a seguir é uma ilustração de como se usar esta teoria para uma avaliação inicial:
Figura 02 - Utilizando os diagramas
Os principais objetivos dos diagramas de Pourbaix são:
- Mostrar as direções das várias reações em determinado pH e potencial.
- Basear a estimativa das composições de produtos de corrosão em várias combinações de pH e potencial.
- Mostrar que pH ambiental e mudanças potenciais reduzirão ou impedirão a corrosão.
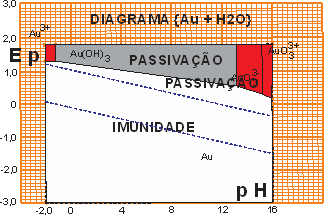
O diagrama de Pourbaix para o OURO é uma referência de suprema importância para uso desta teoria. Na figura a seguir é apresentado entes diagrama e dele deduziremos alguns resultados definitivos para escolha de material de aterramento.
Figura 03 - Diagrama de Pourbaix para {Au}
Observando o diagrama do ouro são evidentes alguns resultados:
- A ampla região de imunidade do metal;
- A ampla região de passividade do metal;
- O elevado potencial catódico na região de Ph ácido;
Estas três “virtudes” torna o material nobre e determina sua grande resistência à corrosão em qualquer tipo de ambiente.
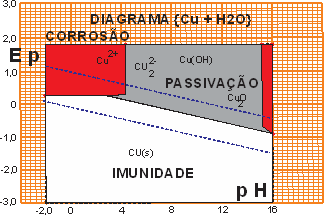
O COBRE é também um metal que tem semelhança com o ouro quando o tema é corrosão, é semiprecioso e bastante caro quando comparado com os demais metais usados para aterramento. Tal como o ouro, o cobre é também um metal catódico (tem potencial eletroquímico positivo). Mas a despeito de semiprecioso é comercialmente viável para aplicações como condutor elétrico, entra no rol dos metais de grande utilidade quando deve ter contato permanente com a terra. A figura a seguir ilustra a semelhança com o diagrama de Pourbaix do ouro e sua similitude com o desempenho frente ao ataque químico de corrosão.
Figura 04 - Diagrama de Pourbaix para {Cu}
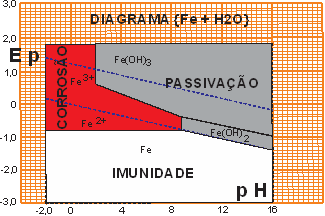
Já os demais metais {Fe, Zn e Al} usados em aterramentos são todos materiais anódicos (perdem elétrons quando em contato com um eletrólito – por exemplo água). O modelo de Pourbaix mostra isto de uma maneira simples, a região de imunidade está sempre a um potencial eletroquímico inferior a 0 (zero).
O FERRO é o menos anódicos dos três. Seus potenciais eletroquímico é -0,44 Volts, sua região de imunidade é ainda bastante ampla, sua região de passivação é também ampla (não esquecer que passivar não é ficar imune é apenas ser corroído mais lentamente). O ferro, quinto elemento mais abundante na crosta terrestre, ocupa um lugar especial no quadro periódico dos elementos. Ele divide a série periódica em ANTES e DEPOIS dele. Depois dele todos os demais elementos são raríssimos (ouro por exemplo) e por sorte o cobre é antes dele e de comportamento catódico como os metais raros depois dele.
Figura 05 - Diagrama de Pourbaix para {Fe}
Antes dos polímeros serem desenvolvidos, o ferro era o metal MOLDÁVEL usado como material de engenharia, por sua área de imunidade e passivação frente as condições ambientais.
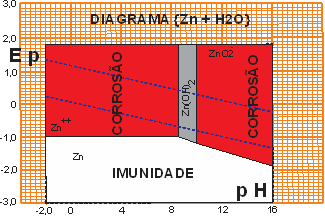
O ZINCO é um metal anódico, quase raro, descoberto na metade do século XVIII. Não é um metal bom condutor elétrico, mas é muito usado como anodo de sacrifício para proteger o Ferro (Aço) contra a corrosão. Como seu potencial eletroquímico é menor que o do ferro, o zinco funciona como anodo, enquanto o ferro (menos eletronegativo) funciona como catodo, quando os dois estão acoplados.
Figura 06 - Diagrama de Pourbaix para {Zn}
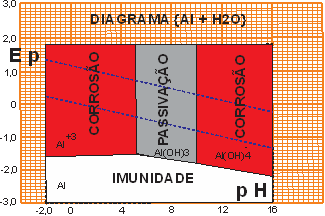
O alumínio é terceiro elemento químico mais abundante na crosta terrestre. Por isso é comercialmente atrativo para aplicações elétricas. Além de naturalmente ter uma condutividade elétrica (61% IACS) muito perto do cobre (100% IACS).
O alumínio é do terceiro período (Tabela periódica) enquanto todos demais metais usados como aterramento são do quarto período. O alumínio possui uma particularidade oxidativa. Quando exposto à presença de oxigênio, forma uma camada (~5 mícrons) de oxido superficial que o protege (passiva) contra a progressão corrosiva. Mas em ambiente aquoso é corroído muito rapidamente. NÃO PODE SER USADO COMO MATERIAL DE ATERRAMENTO.
Figura 07 - Diagrama de Pourbaix para {Al}
Entendido que a eficácia contra a corrosão dos metais é a amplitude da área de imunidade e isto depende da característica catódica do metal, resta ainda as considerações sobre as áreas de passivação do metal.
A propriedade de passivação do metal é observável apenas na superfície e não na massa (“bulk”) do metal. No alumínio a passivação além da área de POURBAIX é observável em toda superfície do metal – Lembrar que o alumínio é do terceiro período e possui naturalmente esta propriedade – Oxidar-se espontaneamente na superfície. Porém o alumínio em meio úmido praticamente e se dissolve.
O zinco possui uma estreitíssima área de passivação no diagrama de POURBAIX. Porem este metal é muito eficiente para proteção do aço em ambiente razoavelmente seco. Mesmo que tenha alguma umidade, mas se esta for eliminada por aeração (ventos!) o zinco pode proteger o ferro (aço) por longos anos – a experiência tem demonstrado isto – mas o zinco se exposto a umidade terá o mesmo fim do alumínio.
O ferro possui uma ampla área de passivação no diagrama de POURBAIX em ambiente úmido. O ferro se transforma em hidróxidos e ali permanece um longo tempo. Porem perde todas propriedades físicas do ferro, há uma exceção! O Ferro fundido maleável! Este foi o material MOLDAVEL mais usado quando não havia antes os polímeros. O ferro fundido maleável tem uma camada de passivação que evolui lentamente a partir da superfície do material e isto é o que garante ainda algumas aplicações mecânicas para este material.
Conclusões
Foi apresentado uma breve imersão na teoria de POURBAIX como conhecimento básico para entendimento do mecanismo de corrosão nos metais usados para aterramento elétrico e dai colhendo-se algumas ASSERTIVAS:
- Os metais catódicos são os únicos que não apresentam corrosão espontânea quando em contato com meio úmido;
- Todos metais anódicos quando em contato com umidade apresentam corrosão espontânea. Aço zincado não poder ser usado em ambiente úmido como material de aterramento.
- O cobre é o único metal catódico comercialmente viável como material de aterramento;
Referências:
[1] M. POURBAIX - Thermodynamique des Solutions Aqueuses Diluées. Représentation Graphique du Role du pH e du Potential. PhD thesis. Université Libre des Bruxelles. (1945)
[2] UHLIG’S CORROSION HANDBOOK – R. WINSTON REVIE – The Electrochemical Society Series –J.WILEY & SONS, INC PUBLICATION
[3] M. G. FONTANA and N.D.GREENE – Corrosion Engineering – INTERTIONAL STUDENT EDITION (1978)